已知SO32-的还原性大于I-的还原性,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
| A.①③ | B.①②③ | C.③④ | D.②③④ |
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol 的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是( )
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ |
| B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+的物质的量之比为1∶2 |
| D.1 mol Fe可还原2 mol Fe3+ |
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
有Fe2+、NO 、Fe3+、NH
、Fe3+、NH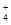 、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.还原产物为NH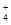 |
| B.氧化剂与还原剂的物质的量之比为8∶1 |
C.若有1 mol NO 作氧化剂,则转移8 mol e- 作氧化剂,则转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-===Fe3+ |
下列对各组离子或物质是否能够大量共存解释正确的是( )
| A |
常温常压下NH3、O2、H2、CO2 |
不能共存 |
NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B |
c(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO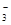 、SO 、SO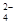 、Na+ 、Na+ |
不能共存 |
发生反应:3Fe2++NO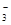 +4H+===3Fe3++NO↑+2H2O +4H+===3Fe3++NO↑+2H2O |
| C |
溶液中:K+、Cu2+、Cl-、NH3·H2O |
不能共存 |
发生反应:Cu2++2OH-===Cu(OH)2↓ |
| D |
溶液中:Al3+、Na+、SO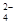 、HCO 、HCO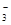 |
可以共存 |
不能发生反应 |
下列实验现象所对应的离子方程式不正确的是( )
| 实验 |
现象 |
离子方程式 |
|
| A |
  |
在空气中放置一段时间溶液呈蓝色 |
4H++4I-+O2===2I2+2H2O |
| B |
  |
开始时无气泡,后来有气泡 |
CO +H+===HCO +H+===HCO HCO  +H+===H2O+CO2↑ +H+===H2O+CO2↑ |
| C |
  |
溶液由黄绿色变为无色 |
Cl2+2OH-===Cl-+ClO-+H2O |
| D |
  |
有白色沉淀生成,溶液由红色变为无色 |
Ba2++OH-+H++SO ===BaSO4↓+H2O ===BaSO4↓+H2O |