在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mol·L-1。
(1)稀释后的溶液中c(H+)= mol·L-1
(2)若a=10,则生成的气体中NO2的物质的量为________mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若上述混合气体被1 mol·L-1的NaOH溶液恰好吸收,则NaOH溶液的体积为________mL
下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
| A.SO2、H2S、Cl2 | B.SO2、O2、NH3 |
| C.SO2、CO2、O2 | D.HCl、H2S、HI |
检验试管中盛有的少量白色固体是铵盐的方法是
| A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.加水溶解,用pH试纸测溶液的酸碱性 |
| C.加入NaOH溶液,加热,再滴入酚酞试液 |
| D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
下列电子式正确的是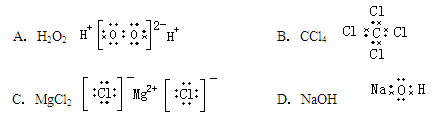
下列有关酸雨的说法正确的是
| A.酸雨就是指pH<7的雨水 |
| B.酸雨是因为雨水中含有CO2 |
| C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 |
| D.酸雨没有危害,所以不必担心,也不必想办法治理 |
(1)钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是 (填电极材料),正极发生的是 反应(填反应类型),
总反应式为 。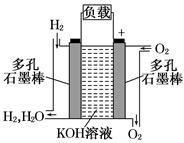
(2)图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。试回答下列问题:
①图中通过负载的电子流动方向______ (填“向左”或“向右”).
②写出氢氧燃料电池工作时正极反应方程式 :
③放电过程中,负极附近溶液的pH (填“增大”,“减小”,“保持不变”)