已知下列元素的原子半径如下表所示:
根据以上数据,磷原子的半径可能是
| A.1.10 ×10-10 m | B.0.80×10-10 m | C.1.20× 0-10 m | D.0.70×10-10 m |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:()
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
下列说法中正确的是()
| A.氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| B.纯净的硅单质是制造光导纤维的基本原料 |
| C.高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害 |
| D.发酵粉中含有苏打,能使焙制出的糕点疏松多孔 |
下列各实验装置图的叙述中,正确的是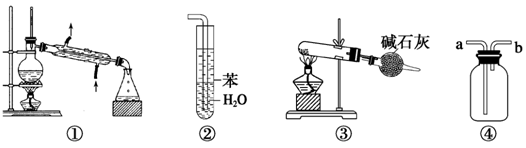
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收氨气,能够防止倒吸 |
| C.以NH4Cl为原料,装置③可用于制备少量NH |
| D.装置④从a口进气可收集Cl2、NO2等气体 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.KSP(AgCl) > KSP(AgI) ,由此可以判断AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是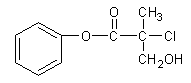
| A.1mol A最多能与4mol H2发生加成反应 |
| B.有机物A可以在一定条件下与HBr发生反应 |
| C.有机物A与浓硫酸混合加热,可以发生消去反应 |
| D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH |