现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径:Y<Q<W |
| B.ZX3可使紫色石蕊溶液变蓝 |
| C.X、Z、Q三种元素可组成离子化合物或共价化合物 |
| D.X2Q2、Y2X6两种分子中含有的电子数、化学键种类都相同 |
【改编】某有机物的分子式为C8H8,经研究表明该有机物不能发生加成反应和加聚反应,在常温下难被酸性KMnO4溶液氧化,但在一定条件下却可与Cl2发生取代反应,而且其一氯代物只有一种。下列对该有机物结构的推断中一定正确的是
| A.该有机物中含有碳碳双键或碳碳三键 |
| B.该有机物属于芳香烃 |
| C.该有机物分子可能是苯的同系物 |
| D.该有机物具有三维空间的立体结构 |
一种形状像布袋结构的烯烃分子Bowtiediene,其形状和结构如下图所示,有关该分子的说法不正确的是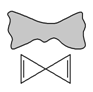
| A.该烯烃的分子式为C5H4 |
| B.该分子所有碳原子在同一平面 |
| C.1 mol该有机物最多可与2 mol Br2发生加成反应 |
| D.与其互为同分异构体且只含三键的链烃不止一种 |
【改编】下图是某有机物分子的球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是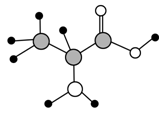
A.分子式为C3H7O2N
B.能发生取代反应
C.能通过聚合反应生成高分子化合物
D.该有机物能使紫色石蕊溶液变红,与NaOH溶液反应,不与盐酸反应
现有两种烯烃:CH2===CH2和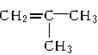 。它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的
。它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的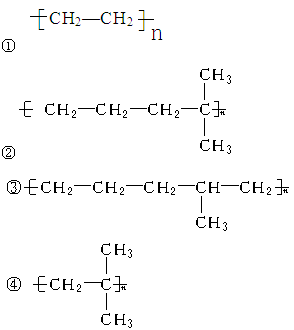
| A.①③④ | B.③ | C.②③ | D.①②④ |
某链状有机物分子中含有n个—CH2—,m个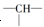 ,a个—CH3,其余为—OH,则羟基的个数为( )
,a个—CH3,其余为—OH,则羟基的个数为( )
| A.2n+3m-a | B.m+2-a |
| C.n+m+a | D.m+2n+2-a |