为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
⑴A点产生气体的质量为 ;
⑵试样中碳酸钠的质量分数(结果精确到0.1%);
⑶B点时,烧杯内溶液中溶质的化学式 。
“黄铜”是铜锌合金,具有较强的机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的。现取20.0g某种黄铜投入100g足量的某浓度稀硫酸中,完全反应后产生氢气的质量为0.2g。请计算:
(1)剩余的溶液和残余固体总质量为g。
(2)这种黄铜中铜的质量分数为多少?请写出计算过程,结果精确到0.1%。
煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染。有一种煤每燃烧1t就会释放出53.3kgSO2。如果将产生的SO2用熟石灰来完全吸收,其反应的化学方程式为:S02+Ca(OH)2==CaSO3+H20,那么燃烧5t这种煤产生的SO2在理论上需用多少千克的Ca(OH)2来吸收?
下图是一种常见的补钙药,还有该药片的说明书。请仔细阅读后回答下列问题:
(1)该葡萄糖酸钙的相对分子质量为;
(2)该葡萄糖酸钙中钙元素的质量分数为;(保留为0.1%)
(3)如果每天服用葡萄糖酸钙12片,则含葡萄糖酸钙g,相当于补充g钙元素;
(4)如果改服用碳酸钙(CaCO3)来补充钙元素,则补充1g钙元素要服用碳酸钙g。
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源。某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题: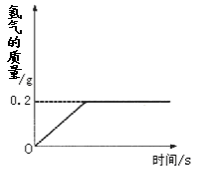
⑴氢化锂与水反应的化学方程式为:
LiH+H2O= +H2↑。
+H2↑。
则X的化学式为;
⑵.氢化锂中Li、H元素质量比为;
(3)反应过程中生成氢气的质量为_______g;
(4)取用氢化锂的质量为多少?
给29.4克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
29.4 |
27.4 |
25.4 |
23.4 |
21.4 |
19.8 |
19.8 |
请回答下列问题:
(1)当氯酸钾完全反应后,生成氧气的质量为g。
(2)剩余固体由哪些物质组成?它们的质量各为多少克?