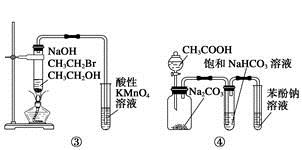
下列关于各实验装置图的叙述中正确的是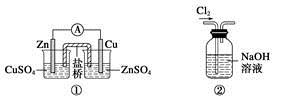
| A.装置①:构成锌—铜原电池 |
| B.装置②:除去Cl2中含有的少量HCl |
| C.装置③:验证溴乙烷发生消去反应生成烯烃 |
| D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
主链含5个碳原子,支链含有一个甲基、一个乙基的烷烃有:( )
| A.2种 | B.3种 | C.4种 | D.5种 |
下列叙述中正确的是( )
| A.标准状况下,2.24L CHCl3含有的分子数为0.1NA |
| B.1.8 g 的NH4+离子中含有的电子数为NA |
| C.常温常压下,48g O3含有的氧原子数为NA |
| D.0.1mol CnH2n+2中含有的碳碳单键数为0.1n NA |
恒温下的定容密闭容器中,有可逆反应2NO(气)+O2(气) 2NO2(气)+热量,不能说明已达到平衡状态的是( )
2NO2(气)+热量,不能说明已达到平衡状态的是( )
| A.反应器中压强不随时间变化而变化 |
B. 正(NO2) = 正(NO2) = 逆(O2) 逆(O2) |
| C.混合气体颜色深浅保持不变 |
| D.混合气体平均分子量保持不变 |
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。下列关于以上实验设计及现象的分析,不正确的是( )
| A.实验①、②说明锌能与稀硫酸反应而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明化学能可以转化为电能 |
反应4 (气)+5
(气)+5 (气)="=" 4NO(气)+6
(气)="=" 4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
(X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A. (NH3)=0.0100mol.L-1.s-1 (NH3)=0.0100mol.L-1.s-1 |
B. (O2)=0.0010mol.L-1.s-1 (O2)=0.0010mol.L-1.s-1 |
C. (NO)=0.0010mol.L-1.s-1 (NO)=0.0010mol.L-1.s-1 |
D. (H2O)=0.045mol.L-1.s-1 (H2O)=0.045mol.L-1.s-1 |