实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: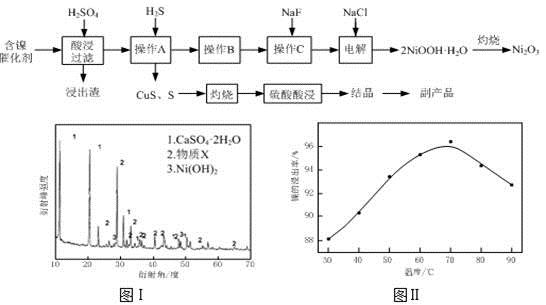
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下��验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价 (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
18.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题: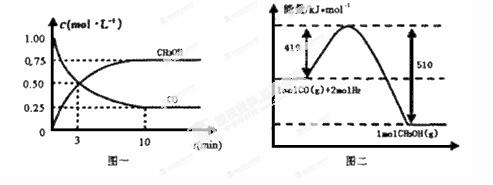
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式_____________________________________________________
(3)恒容条件下,下列措施中能使 n(CO) /n(CH3OH)增大的有。
A.升高温度B.充入He气
C.再充入1 mol CO和2 mol H2D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1 mol CO和2 mol H2 |
a1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
a2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4 mol H2 |
a3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向(填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。
17.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为(1)CH3OH(g)+1.5O2(g)="===" CO2(g)+2 ____ΔH="-704" kJ·mol-1。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能 (E)有关。
已知:H2 (g) + Cl2 (g) = 2HCl (g) △H=-185kJ/mol
E(H—H) = 436kJ/mol E(Cl—Cl) = 243kJ/mol
则E(H—Cl) =kJ/mol
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) + 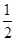 O2(g) ="==" Cu2O(s)ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s)ΔH=-169kJ·mol-1,
C(s)+ 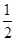 O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)="==" 2CuO(s)ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为_________
27.下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: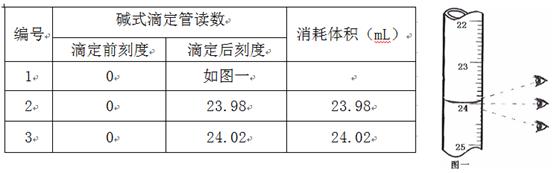
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
26.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
25.发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g)ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g)ΔH =" +23.4" kJ·mol-1
NH3(g)ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH =。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)