为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
(1)鉴别NaCl溶液和Na2CO3的试剂是 ,离子方程式为
(2)除去混入SiO2中少量Al2O3杂质的试剂是 ,离子方程式为
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。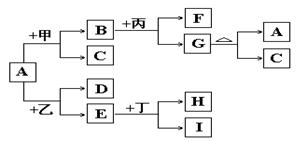
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是,列举A物质的一种用途。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中的;在I溶液中加入氢氧化钠溶液,可以观察到的现象是,对应的离子方程式和化学方程式依次是,
;
(3)写出G A+C的化学方程式:。
A+C的化学方程式:。
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的,该反应的离子方程式为。
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1。则反应物中Fe2O3、Fe、H2SO4的物质的量之比为________。
有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;
③D与A混合生成白烟;
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
(1)写出②化学方程式;
(2)写出④的离子方程式;
(3)气体E有毒,实验室一般用吸收,该反应的离子方程式是__________________________________。
现有下列物质:①铜 ②熔融氯化钠 ③氯化氢 ④CO2⑤NaHSO4固体 ⑥氨水
按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 |
能导电的物质 |
电解质 |
非电解质 |
| 属于该类的物质 |
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的原子结构示意图为;M在元素周期表中的位置为;前五种元素的原子半径从大到小的顺序是(用元素符号表示)。Z、L两元素的第一电离能大小关系为:>(填写元素符号),原因。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子构型为,B的结构式为。
(3)N是人体必需的微量元素,与L同一主族,N原子比L原子多两个电子层,则N的电子排布式为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol H2N反应热的是__________(填字母代号)。
| A.+99.7 mol·L-1 | B.+29.7 mol·L-1 |
| C.-20.6 mol·L-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:;由R生成Q的化学方程式:。