下列有关物质检验的实验结论正确的是
| |
实验操作 |
现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液 |
有白色沉淀生成 |
溶液中一定含有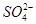 |
| B |
将某气体通入澄清石灰水中 |
变浑浊 |
该气体一定是CO2 |
| C |
向某溶液中加入2滴KSCN溶液 |
溶液不显红色 |
溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 |
溶液变为红色 |
||
| D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热 |
有银镜生成 |
该物质一定是葡萄糖 |
制造光导纤维的材料是一种纯度很高的硅氧化物,它是具有立体网状结构的晶体,图3-15是其简化了的平面示意图,下列关于这种材料的说法中正确的是( )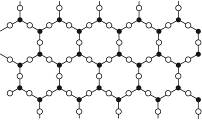
图3-15
| A.晶体中Si与O的数目比是1∶4 |
| B.晶体中Si与O的数目比是1∶6 |
| C.该物质是原子晶体 |
| D.该物质是分子晶体 |
根据下列性质判断,属于原子晶体的物质是( )
| A.熔点2 700 ℃,导电性好,延展性强 |
| B.无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂 |
| C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电 |
| D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电 |
金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
| A.晶体中不存在独立的“分子” |
| B.碳原子间以共价键相结合 |
| C.是硬度最大的物质之一 |
| D.化学性质稳定,即使在高温下也不会与氧气发生反应 |
下列晶体中,其中任何一个原子都被相邻四个原子包围,以共价键形成正四面体,并向空间伸展成网状结构的是( )
| A.C60 | B.冰 | C.金刚石 | D.水晶 |
下列物质熔化时,不破坏化学键的是( )
| A.氯化钠 | B.干冰 | C.金刚石 | D.水晶 |