某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果的准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸根离子能完全转化为沉淀。
其中正确的是
| A.①③ | B.②③ | C.②④ | D.①④ |
下列有关化学用语表示正确的是
A.S2-的结构示意图: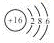 |
| B.常用于考古中文献年代确定的原子:14 6C |
C.H2CO3的电离方程式:H2CO3 2H++CO32- 2H++CO32- |
| D.4g H2在空气25℃.101kPa下燃烧,生成液态的水放出571.6kJ·mol-1的热量,则该反应的热化学方程式为:2H2(g)+O2(g)==2H2O(g);△H=-571.6kJ/mol |
2013年2月,俄罗斯境内有大量陨石坠落,经过化学分析,陨石的游离态的铁含量约为10%左右,此外还有橄榄石(Fe2SiO4)、亚硫酸盐等化学成分,下列有关说法正确的是
| A.此陨石是一种纯度较高的硅酸盐矿石 |
| B.此陨石具有耐酸碱的特性 |
| C.陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D.橄榄石中Fe为+2价 |
化学与社会、环境、生活联系紧密,下列有关说法正确的是
| A.用米汤检测食盐中是否含碘 |
| B.焰火的绚丽是某些金属元素特殊化学性质的体现 |
C.家用臭氧型消毒柜中发生的反应为3O2 2O3 2O3 |
| D.PM2.5颗粒(直径小于或等于2.5微米的颗粒物)在空气中形成胶体 |
碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为L,石灰石中碳酸钙的质量分数为%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为.
(3)第③步反应一般不采用通入CO2的主要原因是,相应的离子方程式为.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是.
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
与前一方案相比较,该方案的优点是.
五种短周期元素X、Y、Z、M、N的原子序数依次增大,X、Y、Z、M是组成蛋白质的基础元素,M原子的最外层电子数是电子层数的3倍,N2M2可用于潜水艇中作为氧气的来源,下列说法错误的是
| A.与Y同主族的短周期元素可与强碱反应生成氢气 |
| B.X和M形成的化合物分子中可能含有非极性共价键 |
| C.由X、Z、M形成的化合物一定是共价化合物 |
| D.等物质的量的N2YM3粉末和NXYM3粉末分别与等浓度的盐酸反应,后者反应速率要快 |