某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
( )
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)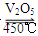 2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是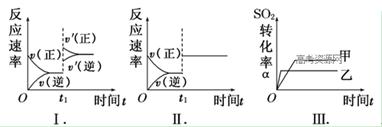
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂②一个N≡N键断裂的同时,有6个N-H键断裂③其它条件不变时,混合气体平均摩尔质量不再改变④保持其它条件不变时,体系压强不再改变⑤NH3%、N2%、H2%都不再改变⑥恒温恒容时,密度保持不变⑦正反应速率υ(H2) =" 0.6" mol/(L·min),逆反应速率υ(NH3) =" 0.4" mol/(L·min)
| A.全部 | B.②③④⑤⑦ | C.①③④⑤ | D.③⑤⑥⑦ |
如图表示外界条件(温度、压力)的变化对下列反应的影响:L(s)+G(g) 2R(g)ΔH>0。在图中Y轴是指
2R(g)ΔH>0。在图中Y轴是指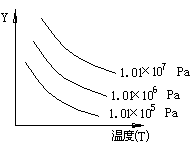
| A.平衡混合气中R的质量分数 | B.G的转化率 |
| C.平衡混合气中G的体积分数 | D.L的转化率 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.③ | C.④ | D.④⑤ |
某温度下,密闭容器中发生反应aX(g)  bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |