判断下列有关化学基本概念的依据不正确的是( )
| A.溶液与胶体:能否发生丁达尔效应 |
| B.氧化还原反应:元素化合价是否变化 |
| C.强弱电解质:在水溶液或熔融状态下能否完全电离 |
| D.共价化合物:是否含有共价键 |
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于
| A.2:7 | B.5:4 | C.4:5 | D.7:3 |
下列化学实验操作或事故处理方法正确的是
| A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硫酸 |
| C.酒精灯着火时可用水扑灭 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为
A.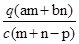 |
B.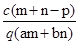 |
C.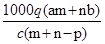 |
D.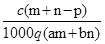 |
若20 g密度为ρ g·cm-3的硝酸钙溶液里含1 g Ca2+,则NO的物质的量浓度是
A.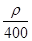 mol·L-1 mol·L-1 |
B.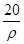 mol·L-1 mol·L-1 |
| C.2.5ρmol·L-1 | D.1.25ρmol·L-1 |
某固体仅由一种元素组成,其密度为5 g/cm3。用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子, 则此元素的相对原子质量最接近
| A.32 | B.65 | C.120 | D.150 |