某烃相对分子质量为86,分子中含有1个—CH2—和4个—CH3,则该烃的一氯取代物的种类有(不考虑立体异构)( )
| A.2种 | B.3种 | C.4种 | D.5种 |
下列溶液加热蒸干、灼烧后,能得到溶质固体的是
| A.AlCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.NH4HCO3 |
下列四个图像的有关说法正确的是
| A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1 |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液 |
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如图,下列说法不正确的是
| A.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
| B.a极为电池的负极 |
| C.电池工作时电流由b极沿导线经灯泡再到a极 |
| D.电池正极的电极反应为:4H+ + O2 + 4e—=2H2O |
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
| A.若增大压强,平衡向正方向移动,平衡常数变大 |
| B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L |
| C.达到平衡时X浓度为0.04 mol/L |
| D.若升高温度,X的体积分数增大,则该反应的DH>0 |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是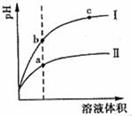
| A.II为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点KW的数值比c点Kw的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |