下列反应属于放热反应的是
| A.氢氧化钡晶体和氯化铵晶体的反应 |
| B.能量变化如图所示的反应 |
| C.化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D.燃烧反应和中和反应 |
根据右下表数据,下列判断正确的是
| 物质 |
HF |
H3PO4 |
| 电离平 衡常数 |
K= 3.6×10—4 |
K1=" " 7.5×10—3 K2=" " 6.2×10—8 K3=" " 2.2×10—13 |
A.在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B.少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-=H2PO4-+HF
C.同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D.结合H+的能力:F—>HPO42—>PO43—
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
| A.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
| B.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA |
| C.一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA |
| D.电解1L NaCl溶液至c(OH-) =" 0.2" mol·L -1,转移电子数为0.4NA(假设电解过程中溶液体积不变) |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.澄清透明溶液:H+、Na+、SO42-、C6H5O- |
| B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- |
| C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2- |
| D.NaHCO3溶液:K+、Na+、SO42-、Al3+ |
某含Na+的溶液中可能含有NH4+、Fe3+、Br—、CO32—、I—、SO32—。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有
| A.取样,滴加硫氰化钾溶液 |
| B.取样,加氯水和CCl4,振荡 |
| C.取样,加足量盐酸加热,湿润的品红试纸检验气体 |
| D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体 |
已知:H2(g)+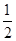 O2(g)=H2O(l)ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l)ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②O2(g)=O2(l)ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l)ΔH4=-44 kJ·mol-1④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+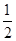 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |