硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应
2SO2 + O2 2SO3的说法中正确的是
2SO3的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应: 2A(g)+B(g)=2C(g)。若经2s后,测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1② 用物质 B表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1其中正确的是
| A.① ③ | B.① ④ | C.② ③ | D.③ ④ |
下列叙述正确的是
| A.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z
极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是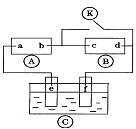
| A.a为直流电源的负极 |
| B.c极发生的反应为O2+4e-+2H2O=4OH- |
| C.f电极为铁板 |
| D.电解质溶液不能用CuCl2溶液 |
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,
设计如下图所示原电池,下列说法错误的是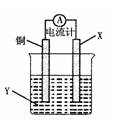
| A.X可以是银或石墨 |
| B.电子从铜电极经外电路流向X电极 |
| C.Y是硫酸铜溶液 |
| D.X极上的电极反应式为 O2+2H2O+4e- = 4OH- |