在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
| A.1.12LH2 | B.1.12LO2 | C.2.24LH2 | D.2.24LO2 |
某新型铝-空气燃料电池,以铝合金为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。下列说法正确的是
| A.以NaCl溶液或NaOH溶液为电解质溶液,两个电池总反应相同。 |
| B.若以NaOH溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]- |
| C.电池工作时,电子通过外电路从正极流向负极 |
| D.若以NaOH溶液为电解质溶液,电池在工作过程中电解质溶液的pH保持不变 |
下列离子方程式书写正确的是
| A.Na2SO3溶液中加入稀硝酸: SO32-+2H+ ==SO2↑+H2O |
B.NH4HSO3溶液与少量的NaOH溶液混合加热:NH4++OH- NH3↑+2H2O NH3↑+2H2O |
| C.FeBr2溶液中通入足量的Cl2: 4Fe2++4Br-+3Cl2==4Fe3++2Br2+6Cl- |
| D.向碳酸氢钙溶液加入少量氢氧化钾溶液: |
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32—
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3++N2+3C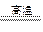 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.AlN是氧化产物 |
| C.上述反应中,每生成1molAlN需转移3mol电子 |
| D.上述反应中,C元素被还原 |
下表所列各组物质中,物质之间通过一步反应就不能实现如图所示转化的是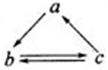
| 物质选项 |
a |
b |
c |
| A |
Al2O3 |
AlCl3 |
Al(OH)3 |
| B |
C |
CO |
CO2 |
| C |
SiO2 |
Na2SiO3 |
H2SiO3 |
| D |
Fe |
FeCl3 |
FeCl2 |
下述实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将 溶液蒸干 溶液蒸干 |
得到Al(OH)3 |
| B |
向沸水中滴加几滴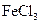 饱和溶液,持续续加热,并不断搅拌 饱和溶液,持续续加热,并不断搅拌 |
制备 胶体 胶体 |
| C |
向某溶液中加入盐酸,将产生的气体通入澄清石灰水 |
检验溶液中是否含有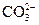 |
| D |
相同温度下,测定浓度分别为0.1mol·L-1的NaHCO3和 溶液的pH 溶液的pH |
比较碳酸和醋酸电解质能力强弱 |