X、Y两根金属棒插入Z溶液中构成下图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )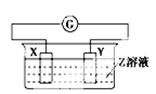
| 编号 |
X |
Y |
Z |
| A |
Zn |
Cu |
稀硫酸 |
| B |
Cu |
Zn |
稀硫酸 |
| C |
Cu |
Ag |
硫酸铜溶液 |
| D |
Ag |
Zn |
硝酸银溶液 |
2001年11月,美军向躲藏在山洞中的阿富汗恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸能耗尽山洞中的氧气,使洞中的生物窒息死亡。该炸弹的主装药是环氧乙烷(化学式为C2H4O)。关于环氧乙烷的下列说法正确的是()
| A.它是氧化物 | B.它是含有3种元素的混合物 |
C.它的摩尔质量是 44g 44g |
D.1 mol环氧乙烷含有2NA个碳原子 |
在标准状况下,18gCO和CO2的混合气体的体积为11.2L。则此混合气体中CO和CO2的质量之比是()
A.1:1 |
B.1:7 | C.1:11 | D.7:11 |
用CCl4萃取碘的饱和水溶液中的碘,下列说法不正确的是()
| A.碘的CCl4溶液呈紫红色 |
| B.碘在CCl4中的溶解度比在水中的溶解度大 |
| C.萃取时,要充分振荡混合液体并适当旋转活塞排气减压 |
| D.分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |
下列关于物质分类的叙述错误的是()
A.饱和食盐 水属于混合物 水属于混合物 |
B.Na2CO3既属于钠盐又属于碳酸盐 |
| C.CuSO4·5H2O属于混合物 | D.纯净物一般可分成单质和化合物两类 |
胶体的最本质的特征是()
| A.丁达尔效应 | B.可以通过滤纸 |
| C.布朗运动 | D.分散质粒子的大小在1nm~100nm之间 |