1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是 ( )
| A.该合金中铜与镁的物质的量之比是2 ︰1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54沉淀时,加入NaOH溶液的体积是600mL |
某有机物的结构简式如右图,该物质不应有的化学性质是
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液褪色;④可跟NaHCO3溶液反应;⑤可跟NaOH溶液反应; ⑥可在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.⑥ |
甲烷和丙烷混合气的密度与同温同压下乙烷的密度相同,混合气中甲烷和丙烷的体积比是
| A.2:1 | B.3:1 | C.1:3 | D.1:1 |
芳香族化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的A的同分异构体的数目是
| A.5 | B.4 | C.3 | D.2 |
m molC2H2跟n molH2在密闭容器内反应,当其达到平衡时,生成p molC2H6。将平衡混合气体完全燃烧,所需O2物质的量是
| A.(3m+n)mol | B.(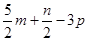 )mol )mol |
C.(3m+n+2p)mol | D.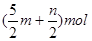 |
已知乙炔(C2H2),苯(C6H6),乙醛(C2H4O)的混合气体中氧的质量分数为8%,则混合气中氢的质量分数为
| A.8% | B.9% | C.10% | D.5% |