下列分子或离子在指定的分散系中能大量共存的一组是
| A.银氨溶液: Na+、K+、NO3-、NH3·H2O |
| B.空气: C2H2、CO2、SO2、NO |
| C.氢氧化铁胶体: H+、K+、S2-、Br- |
| D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO32-数为0.1NA
| A.②④⑤ | B.①③⑤ |
| C.①②④⑤ | D.①②③ |
据报道,科学家研制出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )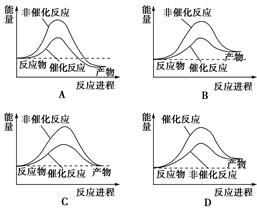
下列化学用语表示正确的是( )
A.Cl-的结构示意图: |
B.甲烷分子的球棍模型: |
C.氢氧化钠的电子式: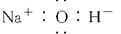 |
| D.次氯酸的结构式:H—O—Cl |
下列叙述不正确的是( )
| A.用熟石灰可处理酸性废水 |
| B.用丁达尔效应可区分溶液和胶体 |
| C.漂白粉能用来杀菌消毒,属于纯净物 |
| D.明矾净水是因为Al3+水解生成Al(OH)3胶体,吸附水中悬浮物 |