某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下: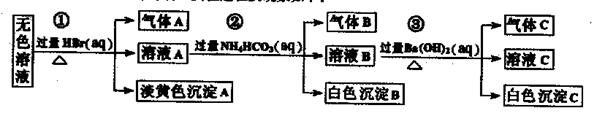
下列说法正确的是
| A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr |
| B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ |
| C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 |
| D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
甲烷、乙烯、苯、乙醇是四种常见的有机物,下列关于他们的性质说法中正确的是
| A.这四种有机化合物都是烃 |
| B.乙烯是一种重要的化工原料,可以用于合成乙醇 |
| C.苯分子中含有不饱和键,因此它与乙烯的性质相似,能使酸性高锰酸钾溶液褪色 |
| D.这四种有机化合物都能燃烧,而且燃烧产物都是二氧化碳和水 |
据统计,约有80%~85%的化工生产过程使用催化剂,同样在化学实验室进行物质的制备时,也同样用到催化剂。以下反应需用催化剂才能顺利进行的是
| A.工业合成氨 | B.工业上用氯气制取漂白粉 |
| C.工业制硫酸 | D.实验室制取溴苯 |
列物质属于“城市空气质量日报”报道内容的是()
| A.二氧化硫 | B.氮氧化物 | C.二氧化碳 | D.悬浮颗粒 |
关于钠的叙述中,正确的是
| A.钠在空气中燃烧生成过氧化钠 |
| B.钠是银白色金属,硬度很大 |
| C.钠投入乙醇中,会浮在液面 |
| D.钠的保存要注意防水、防空气 |
下表列出了除去物质中所含少量杂质的方法,其中正确的是( )
| 物质 |
所含杂质 |
除去杂质的方法 |
|
| A. |
CO |
CO2 |
通过足量氢氧化钠溶液,干燥 |
| B. |
NaCl |
CaCO3 |
溶解、过滤、蒸发 |
| C. |
KOH溶液 |
K2CO3 |
加入足量稀盐酸至不再产生气泡 |
| D. |
Cu(NO3)2溶液 |
AgNO3 |
加入过量的铜粉,过滤 |