某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32―、SO32―、SO42―、C1―、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下: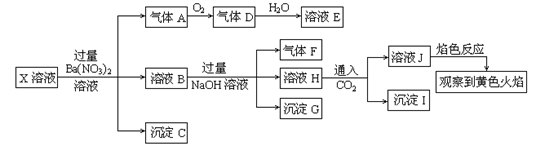
下列结论正确的是
| A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42― |
| B.气体F经催化氧化可直接生成气体D |
| C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3 |
| D.X中不能确定的离子是 A13+、Na+、K+和C1― |
下列说法正确的是
A.已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色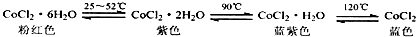 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C.2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是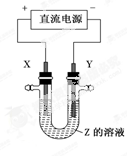
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
2008年,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果 |
| D.钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-==Fe3+,继而形成铁锈 |
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
| A.10℃20mL 3mol/L的X溶液 | B.20℃30mL 2mol/L的X溶液 |
| C.20℃10mL 4mol/L的X溶液 | D.10℃10mL 2mol/L的X溶液 |
下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是



| A.电解水 | B.水力发电 | C.太阳能热水器 | D.干电池 |