NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
25℃时,10mL0.1mol·L-1的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是()
| A.该溶液的pH约是4 |
| B.HA一定是一种弱酸 |
| C.恰好中和时消耗NaOH的物质的量是10-6 mol |
| D.与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL |
已知反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )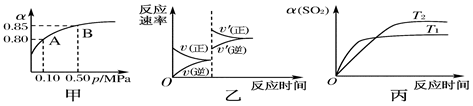
| A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
温度为t ℃,压强为1.01×106Pa的条件下,某密闭容器内,下列反应达到化学平衡:A(g)+B(g)  3C,测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107 Pa,第三次达到平衡时,测得c(A)=0.075 mol·L-1,则下列关于C物质状态的推测正确的是( )
3C,测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107 Pa,第三次达到平衡时,测得c(A)=0.075 mol·L-1,则下列关于C物质状态的推测正确的是( )
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为气态
pH均为2的HCl和CH3COOH的两种溶液各1L,分别加入足量Na2CO3粉末,下列说法正确的是()
| A.二者反应的平均速率相等 | B.二者溶质的物质的量浓度不相等 |
| C.二者生成二氧化碳的体积相等 | D.二者中氢离子的浓度不相等 |
在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)  2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时H2的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时H2的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
| A.2 mol H2(g)和1 mol I2(g) | B.3 mol HI(g) |
| C.2 mol H2(g)和2 mol I2(g) | D.1 mol I2(g)和2 mol HI(g) |