根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其它反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
|
Cl- |
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
2001年我国科学家巧妙合成了某超重元素的一种新核素 ,并在世界上首次确认了
,并在世界上首次确认了 缓发裂变先驱核
缓发裂变先驱核 。根据以上信息回答下列问题:
。根据以上信息回答下列问题:
(1) 的中子数为( )
的中子数为( )
A. 105 B. 154 C. 259 D. 364
(2) 的中子数和电子数的差值为( )
的中子数和电子数的差值为( )
A. 105 B. 154 C. 49 D. 259
常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中,一定不能大量共存的离子组是
| A.Cl- AlO2- Na+ K+ | B.Fe3+ NO3- MnO4- K+ |
| C.Fe2+ NO3- Ba2+ Cl- | D.SO42- Na+ Cl- K+ |
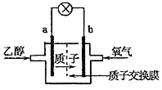
C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,正确的是
| A.电池工作时,质子向电池的负极迁移 |
| B.电池工作时,电流由b极沿导线流向a极 |
| C.a极上发生的电极反应是: C2H5OH+3H2O+12e-=2CO2+12H+ |
| D.b极上发生的电极反应是:4H++O2+4e-=2H2O |
| A.在0.1 mol/L CH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-) |
| B.常温下将10 mL 0.02 mol/L NaOH溶液与l0 mL0.02 mol/L H2SO4溶液充分混合, 若混合后溶液的体积为20 mL,则混合后溶液的pH=2 |
| C.在0.1 mol/L NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-) |
| D.在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
A.A、B、C分别与D形成的化合物的热稳定性依次增强
B.由A、C原子构成的分子和B、D原子构成的分子都是极性分子;
C.B、C、D三种元素可以形成酸、碱或盐三类物质
D.E的单质在冷的浓硝酸中会发生钝化现象