在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 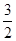 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=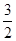 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+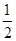 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
| A.△H4=2/3(△H1+△H2-3△H3) |
| B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=3/2(△H1+△H2-3△H3) |
| D.△H4=3/2(△H1-△H2-3△H3) |
背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价)。
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂。
下列说法不正确的是
| A.石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 |
| B.压减燃煤、严格控车、调整产业是治理雾霾的有效措施 |
| C.新的铁基超导材料中Fe的化合价呈+2、+3价 |
| D.该分子催化剂可将一次能源太阳能直接转化成二次能源 |
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。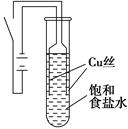
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e-¯ ═ H2↑+ 2OH-¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计),则下列说法错误的是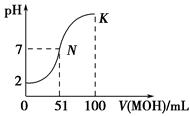
| A.常温下,MA的水溶液的pH=a,由水电离产生的c(H+)=1×10-a mol·L-1 |
| B.在K点,水溶液中存在:c(M+) = 2c(A-) |
| C.在N点,水溶液中存在:c(M+) + c(H+)= c(A-)+ c(OH-) |
| D.在K点,若此时溶液的pH=10,则c(MOH)+c(M+)=0.01mol·L-1 |
25℃时,溶液只含有Na+、H+、OH-、CH3COO-这四种离子,下列说法错误的是
| A.溶液只能是CH3COONa溶液 |
| B.溶液中的离子浓度可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.溶液中的离子浓度可能是c(Na+)> c(CH3COO-)> c(OH-)>c(H+) |
| D.溶液中的离子浓度可能是c(Na+)> c(OH-)> c(CH3COO-)> c(H+) |
下列各组离子一定能大量共存的是
| A.含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3- |
| B.加入Al有H2生成的溶液中:Na+、K+、Cl-、NO3- |
| C.NaOH溶液中:K+、Na+、AlO2-、CO32- |
| D.NaHCO3溶液中:K+、Al3+、Cl-、SO42- |