下列说法不正确的是
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
CO(g)+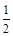 O2(g)
O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应
PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3) / mol |
0 |
0. 16 |
0. 19 |
0. 20 |
0. 20 |
下列说法正确的是
A.反应在前50 s 的平均速率v(PCl3)=" 0." 0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则反应的H<0
C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2,达到平衡时,PCl3的转化率小于80%
已知下列热化学方程式:
①CH4(g)+2O2(g)==CO2(g)+2H2O(l)△H=-889.5kJ/mol
②2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l)△H=-3116.7kJ/mol
③C2H4(g)+3O2(g)==2CO2(g)+2H2O(l)△H=-1409.6kJ/mol
④2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)△H=-2596.7kJ/mol
⑤C3H8(g)+5O2(g)==3CO2(g)+4H2O(l)△H=-2217.8kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出3037.6kJ热量,则下列哪些组合是不可能的()
| A.C2H4和C2H6 | B.C2H2和C3H8 | C.C2H6和C3H8 | D.C2H6和CH4 |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
| A.υ(NH3)=0.010mol/(L·s) | B.υ(O2)=0.0010mol/(L·s) |
| C.υ(NO)=0.0010mol/(L·s) | D.υ(H2O)=0.045mol/(L·s) |
用过量铁片与稀盐酸反应,为加快其反应速率而生成氢气的量不变,下列措施中可行的是①以铁屑代替铁片②用过量锌片代替铁片③在稀盐酸中加入少量CuSO4溶液④在稀盐酸中加入CH3COONa固体⑤在稀盐酸中加入等物质的量浓度的硫酸⑥在稀盐酸中加入硫酸钾溶液⑦微热(不考虑HCl的挥发)⑧在稀盐酸中加入NaNO3固体
| A.除④外 | B.除④⑤⑥⑧外 | C.除④⑥外 | D.全部都可行 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
| A.在0-50min之间, pH ="2" 和 PH=" 7" 时 R 的降解百分率相等 |
| B.溶液酸性越强, R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在 20-25min之间, pH =" 10" 时 R 的平均降解速率为 0.04mol·L-1·min-1 |