25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol |
短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如下图所示,其中只有Z为金属元素。则下列说法中,正确的是
| A.W、X两种元素在自然界中都存在相应的单质 |
| B.Q、Y分别与活泼金属元素形成的化合物中仅含离子键 |
| C.Y、Z分别形成的简单离子中,前者的半径较大 |
| D.X、Z的最高价氧化物对应的水化物之间容易相互发生反应 |
下列选项中,为完成相应实验,所用仪器或相关操作合理的是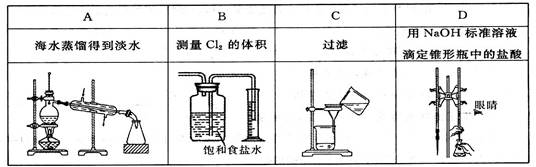
下列各项中,左、右两边说明的逻辑关系正确的是
(18分)自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在。用黄铜矿炼铜的总反应为: 。
。
(1)该反应中_______元素被还原,如果在反应中生成1molCu,转移电子数为____(用NA表示阿伏加德罗常数)。
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式_______(用一个方程式表示)若想提高该过程中SO2的除去速率,可采取的措施为_______(填序号)
| A.增大氨水浓度 |
| B.升高反应温度 |
| C.使气体与氨水充分接触 |
| D.通入空气使HSO3-转化为SO42- |
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是_______(用离子方程式表示),若水解常数用Kb表示,则该溶液中铵根离子的水解常数Kb约为______________.
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH):n(SO2)=_______时,吸收SO2的成本最低,所得吸收液中各离子浓度大小关系是_______,向吸收液中加入NaOH可得到_______。
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示。若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,下列有关说法正确的是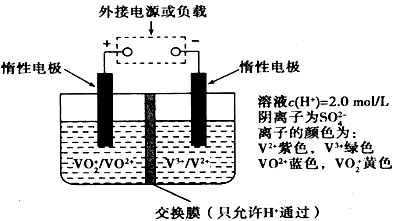
| A.外接负载时,左槽作为原电池负极,发生氧化反应 |
| B.外接电源时,左槽连接外接电源的正极,发生还原反应 |
| C.负载是镀铜的电镀槽时,H+由左槽向右槽移动 |
| D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |