某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ·mol-1 |
| B.逆反应活化能一定小于100kJ·mol-1 |
| C.正反应活化能不小于100kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100kJ·mol-1 |
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是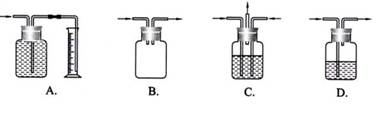
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为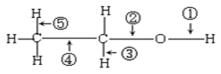
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
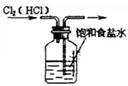
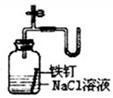
如图所示的实验中,能达到实验目的的是
 |
 |
 |
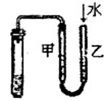 |
| ①除去Cl2中的HCl杂质 |
②用铜和稀硝酸制取少量NO |
③证明铁生锈时空气参与反应 |
④检验装置气密性 |
A.①②③④ B.③④ C.②③④ D.①④
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是
| A.炭棒应与玩具电机的负极相连 |
| B.炭粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.铝罐将逐渐被腐蚀 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |
下列混合溶液中,各离子浓度的大小顺序不正确的是()
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |