根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
向水中加入等物质的量Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为
| A.8∶1 | B.2∶1 | C.1∶1 | D.1∶2 |
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)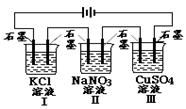
| A.13、7、1 | B.12、7、2 |
| C.1、7、13 | D.7、13、1 |
已知下列热化学方程式:
Zn(s)+O2(g)=ZnO(s)ΔH=-Q1 kJ / mol
Hg(l)+O2(g)=HgO(s)ΔH=-Q2kJ / mol
Zn(s)+HgO(s)=Hg(l) +ZnO(s)ΔH=-Q3kJ / mol
Q3值为
| A.Q2 - Q1 | B.Q1+ Q2 | C.Q1- Q2 | D.-Q1- Q2 |
将2molSO2和2molSO3气体,混合于一固定体积的密闭容器中,在一定条件下发生反应:2SO2+O2 2SO3平衡时SO3为W mol;在相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于W mol的是
2SO3平衡时SO3为W mol;在相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于W mol的是
| A.2molSO2 、1molO2 | B.4molSO2 、1molO2 |
| C.2molSO2 、1molO2、2mol SO3 | D.1molSO2 、2mol SO3 |
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是
| A.自来水 | B.0.5mol·L—1KOH溶液 |
| C.0.5mol·L—1醋酸 | D.0.5mol·L—1NH4Cl溶液 |