下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下列判断正确的是
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
| A.原子半径:丙<丁<戊 | B.第一电离能:甲>丙 |
| C.电负性:丙>丁>戊 | D.最外层电子数:甲>乙 |
下列判断错误的是
A.沸点:NH3>PH3>AsH3 |
B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.酸性:HClO4>H2SO4>H3PO4 | D.熔点:SiC>NaCl>SiCl4 |
下列有关物质结构的表述正确的是
A.次氯酸的电子式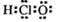 |
B.二氧化硅的分子式SiO2 |
C.硫原子 的最外层电子排布式为3s23p4 的最外层电子排布式为3s23p4 |
D.钠离子的结构示意图为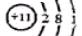 |
下列化合物分子中的所有原子都处于同一直线的是
| A.C2H2 | B.C2H4 | C.PCl3 | D.BF3 |
某元素质量数52,中子数28,其基态原子未成对电子数为
| A.3 | B.4 | C.5 | D.6 |