有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1 |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示: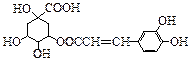
关于咖啡鞣酸的下列叙述不正确的是
| A.分子式为C16H18O9 |
| B.与苯环直接相连的原子都在同一平面上 |
| C.1 mol咖啡鞣酸水解时可消耗8 mol NaOH |
| D.与浓溴水既能发生取代反应又能发生加成反应 |
下列表示物质的化学用语正确的是(
A.NH4H的电子式: |
B.硝基苯的结构简式: |
| C.葡萄糖的实验式:CH2O | D.甲烷分子的比例模型: |
2008年北京残奥会吉祥物是 “福牛乐乐”。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇。下列有关牛式二烯炔醇的说法中正确的是
| A.化学式为C29H44O,属于不饱和醇 |
| B.分子内所有碳原子都在同一平面 |
| C.能发生加成、消去、取代反应 |
| D.一定条件下羟基能被氧化为醛基 |
第一次冲击“有机物就是有生命力的物质”的科学家及其制成的物质是
| A.杜康,酒精 | B.维勒,尿素 | C.诺贝尔,雷管 | D.凯库勒,苯 |
某有机物甲经氧化后得乙(分子式为C2H3O2Cl),而甲经水解可得丙。1 mol丙和2 mol乙反应得一种含氯的酯 (C6H8O4Cl2),由此推断甲的结构简式为
(C6H8O4Cl2),由此推断甲的结构简式为
A.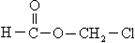 |
B.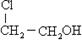  |
C. |
D.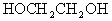 |