I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:
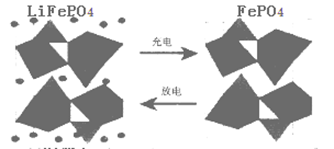
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
下图是常用的实验仪器:(铁架台和玻璃导管、橡皮管、瓶塞等略去)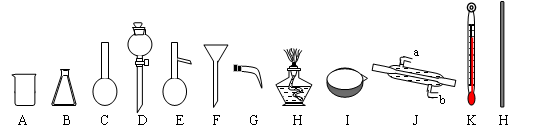
用仪器对应的英文字母及相关文字填空:
(1)填写以下仪器的名称:BDEI
(2)用四氯化碳提取出溴水中Br2单质的方法叫做:。能否用酒精代替四氯化碳进行
实验?原因是:
(3)将Br2的四氯化碳溶液和水分离开的操作叫做:。下列是进行该操作的步骤,正确的
顺序是:
① 将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层;
② 从分液漏斗上口倒出上层水溶液;
③ 将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④ 分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤ 检查分液漏斗活塞和颈部的玻璃塞是否漏水
(4)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃。将Br2的四氯化碳溶液分离开的方法是,
需要用到的仪器有。连接装置时,仪器J的冷凝水应该进出(填a、b)。
计算
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比
是,原子数之比是,质量之比是,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是;含有原子数最多的
是;标准状况下体积最大的是。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在
标准状况下的体积是(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的
浓H2SO4(密度为1.84g/cm3)的体积为。
A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧
的产物可使品红溶液褪色。F和C元素形成的化合物F3C4具有磁性。A的单质在C2中燃烧
可生成AC和AC2两种气体。D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两
种固体。请回答下列问题:
⑴B的单质分子的电子式为;F3C4的化学式为;
F元素在周期表中的位置是_____________。
⑵写出D在AC2剧烈燃烧生成黑白两种固体的化学反应方程式
⑶A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)____________;
B、C的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子
方程式加以证明____________________________。
⑷EC2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离
子方程式为__________________________________________,由此可知BC2和EC2还
原性较强的是(写化学式)______________________________。
A、B、C、D、E是常见的几种粒子,其中A、B为分子,C、E为阳离子,D为阴
离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种粒子反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:;B :;C:;D :(2)写出A、B、E三种微粒反应的离子方程式:
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验
室里从海洋中提取碘的流程如下:
⑴指出提取的过程中有关实验操作名称:①;③;
⑵提取碘的过程中,可供选择的溶剂是__________。
| A.酒精 | B.四氯化碳 | C.乙酸 | D.苯(E)水 |
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出下图所示实验装置中的错误之处;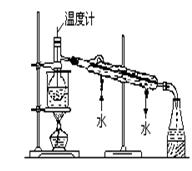
① ; ②;③。
(4)进行上述蒸馏操作时,使用水浴的原因是;最后碘晶在里聚集。