节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应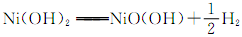 。其放电时的正极的电极反应方程式为 。
。其放电时的正极的电极反应方程式为 。
③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是 。0.1mol·L-1 Na2CO3中阴离子浓度大小关系是 ,向0.1mol·L-1 NaHCO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为: 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:
①操作Ⅰ需要的玻璃仪器是 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为 ,上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为 。
( 6分)(1)键线式 表示的分子式;名称是。
表示的分子式;名称是。
(2) 中有氧官能团的名称为
中有氧官能团的名称为
按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类(填写字母),填在横线上。
| A.烷烃 | B.烯烃 | C.炔烃 | D.醚 E.酚 F.醛 G.羧酸 H.苯的同系物 I.酯 J.卤代烃 K.醇 |
(1)CH3CH2CH2COOH__________; (2)  ________;
________;
(3)  _______; (4)
_______; (4)  ______;
______;
(5)  ______; (6)
______; (6)  ________。
________。
有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成。为了判断其中的成份,某同学设计了如下实验方案,并 进行了实验现象的假设,请你帮助他对这些假设作一些判断:
进行了实验现象的假设,请你帮助他对这些假设作一些判断:
| 实验步骤 |
实验现象 |
判断 |
| 取固体溶于水 |
①若只得到蓝色溶液 |
一定没有____________________________。 |
| ②若有白色沉淀,静置,上层溶液无色 |
一定没有___________________________。 |
|
| 取②的混 合物过滤 |
③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀 |
一定含有_____________________________, 沉淀中加入盐酸的离子方程式: _______________________________________。 能否确定原固体中是否含有NaCl,并说明理由 _______________________________________ _______________________________________。 |
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
 |
|||||||||||||||||
| A |
B |
C |
|||||||||||||||
| D |
E |
||||||||||||||||
| N |
M |
Q |
|||||||||||||||
⑴A、B、C原子的第一电离能由小到大的顺序是__________(用元素符号表示);
Q元素基态原子电子排布式为。
⑵写出BC2+的电子式,1mol BC2+中含有的π键数目为。
⑶化合物甲由B、D两元素组成,已知甲是一种重要的结构材料,硬度大,耐磨损,晶胞如图1所示甲的晶体中B、D两种元素原子的杂化方式均为。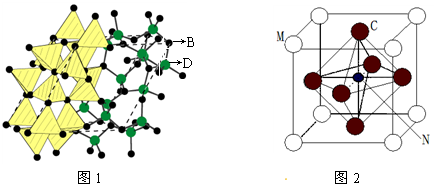
⑷法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔因在巨磁电阻效应(CMR效应)研究方面的成就而获得诺贝尔物理学奖。如图2的化合物具有CMR效应,则该化合物的化学式为。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
⑴反应Ⅰ的焓变△H1=。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4=。
与CO和H2相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化 学式)
学式)
②负极的电极反应式为。