NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,下列说法正确的
A.原子半径的大小顺序为:rA>rB>rC>rD>rE
B.元素D的最高价氧化物对应的水化物的酸性比E的强
C.A、D两种元素在自然界中都存在相应的单质
D.C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应
下列说法中正确的是
| A.纯净物中一定存在化学键 |
| B.阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
| C.只有金属元素和非金属元素化合时才能形成离子键 |
| D.离子化合物中可能含共价键,共价化合物中不含离子键 |
下列判断错误的是
A.沸点: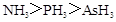 |
| B.熔点:MgO>NaCl>KCl |
C.酸性: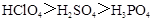 |
D.碱性: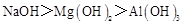 |
下列有关元素的性质及其递变规律叙述正确的是
| A.同主族元素形成的单质熔沸点自上而下逐渐升高 |
| B.核外电子排布相同的微粒化学性质不一定相同 |
| C.第三周期中,除稀有气体元素外原子半径最大的是氯 |
| D.同主族元素氢化物的稳定性越强其沸点就越高 |
下列分子中所有原子都满足最外层8电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |