反应X(g)+Y(g) 2Z(g);
2Z(g); H<0,达到平衡时,下列说法正确的是( )
H<0,达到平衡时,下列说法正确的是( )
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
下列反应中符合下图图像的是( )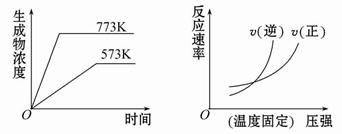
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) |
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
根据以上数据,下列叙述正确的是( )
| A.在上述条件下反应生成1 mol SO3固体放热Q/2 kJ | B.2Q3<2Q2=Q1<Q |
| C.Q1=2Q2=2Q3=Q | D.2Q2=2Q3<Q1<Q |
下列情况下,反应速率相同的是( )
| A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
一定条件下,在体积为10 L的密闭容器中,2 mol X和2 mol Y 进行反应:2X(g)+Y(g) Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol①
Fe2O3(s)+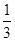 CO(g)=
CO(g)=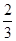 Fe3O4(s)+
Fe3O4(s)+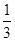 CO2(g) ΔH=-15.73 kJ/mol②
CO2(g) ΔH=-15.73 kJ/mol②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol③
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
| A.-218 kJ/mol | B.-109 kJ/mol |
| C.+218 kJ/mol | D.+109 kJ/mol |