在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2 + O2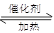 2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g |
| D.达到平衡时,SO2的转化率为90% |
下列说法不正确的是
| A.凡是铵盐均能与苛性钠共热产生氨气 |
| B.向铜粉中加人稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解 |
| C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
| D.将二氧化硫通人溴水,溴水褪色后加热不能恢复原色 |
下面不能由单质直接化合而得到的化合物是
| A.FeS | B.Al2S3 | C.FeCl2 | D.Fe3O4 |
下列物质与盐酸、NaOH均能反应的是
①NaHCO3②Al③NH4HCO3④Al(OH)3⑤NaHSO4⑥Si
| A.①②③④ | B.②③⑤⑥ | C.②③⑤ | D.②③④⑤⑥ |
将10 mL NO和NO2的混合气体通入装满水的倒立在水槽中的量筒里,充分反应后,最后剩余4mL气体,则原混合气体中NO的体积为
| A.1mL | B.3mL | C.5mL | D.7mL |
下列四种有色溶液与SO2气体作用时均能褪色,其实质相同的是
①红色的品红溶液;②紫色的酸性KMnO4溶液;③橙色的溴水;④显红色(含NaOH)的酚酞溶液
| A.①④ | B.②③ | C.①③ | D.②④ |