理综化学试卷)
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 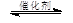 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)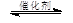 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)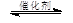 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1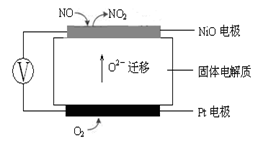

图1 图2
①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2) / n(CH4)]
、X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氧化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)写出X单质的一个重要用途
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是(填化学式)。
(3)实验室制备X最简单气态氢化物的化学方程式
(4)将少量Y的最高价氧化物通入硅酸钠溶液中反应的离子方程式
(5)W单质与氢氧化钠溶液反应的离子方程式
(6)Z单质在加热的条件下与浓氢氧化钠溶液反应,氧化产物与还原产物的物质的量之
比为1:5则反应的离子方程式
(12分)(1)有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体。A完全燃烧后生成二氧化碳与水物质的量之比是2:1;B的分子量是A的三倍;C既不能使酸性高锰酸钾溶液褪色也不能使溴水褪色,但在光照条件下最多可与六倍体积氯气发生反应;燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,在催化剂作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。试推断有机物A、B、C、D,分别写出结构简式:
A:______________ B:_____________
C:______________ D:___________
(2)相对分子质量为72的某烃,其分子式是___________,若此有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
下图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)写出有机物(a)的系统命名法的名称 _________
(2)有机物(a)有一种同分异构体,试写出其结构简式 __________
(3)上述有机物中与(c)互为同分异构体的是(填代号)
(4)任写一种与(e)互为同系物的有机物的结构简式 ______
(5)上述有机物中不能与溴水反应使其退色的有(填代号)
写出下列反应的化学方程式,并指出该反应属于何种反应类型
(1)丙烯通入溴水使溴水退色
(2) 苯和溴单质在铁粉作催化剂条件下反应
(3)工业上由乙炔制聚氯乙烯
________________________
(1)下列有机化合物都有各种官能团,请回答 
可看作醇类的是 可看作酚类的是
可看作羧酸类的是 可看作醛类的是___________________