一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e- + H2O = CH3COOH + 4H+。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
| A.C(s)+1/2O2(g)=CO(g)△H=" -393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=" -571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" +890.3" kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(g)△H=" -2800" kJ/mol |
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
下列说法不正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.对于ΔH>0的反应,反应物的能量小于生成物的能量 |
| C.放热反应都不需要加热就能发生 |
| D.吸热反应在一定条件(如常温、加热等)下也能发生 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH=" -566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" -226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为566 kJ/mol |
B.图可表示由CO生成CO2的反应过程和能量关系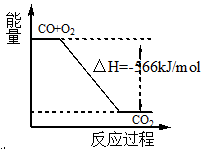 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol |
| D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物质的量为为2 mol |
反应C (s) + H2O (g)  CO (g) + H2 (g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO (g) + H2 (g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 |
| D.保持压强不变,充入N2使容器体积变大 |