将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是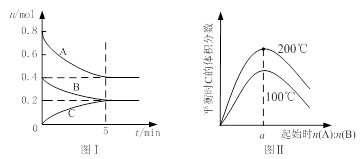
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 |
X产生氢气的体积比Y多 |
金属性:X>Y |
| B |
向滴有甲基橙的AgNO3溶液中滴加KCl溶液 |
溶液由红色变为黄色 |
KCl溶液具有碱性 |
| C |
在CuSO4溶液中加入KI溶液,再加入苯,振荡 |
有白色沉淀生成,苯层呈紫色 |
白色沉淀可能为CuI |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
下图是某同学设计的原电池装置,下列叙述中正确的是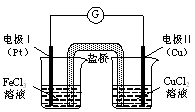
| A.电极Ⅰ上发生还原反应,作原电池的正极 |
| B.电极Ⅱ的电极反应式为:Cu2++2e-=" Cu" |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。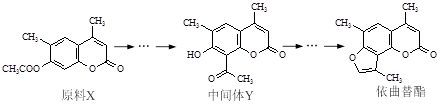
下列说法正确的是
| A.原料X与中间体Y互为同分异构体 |
| B.原料X可以使酸性KMnO4溶液褪色 |
| C.中间体Y能发生加成、取代、消去反应 |
| D.1 mol依曲替酯只能与1 mol NaOH发生反应 |
下列有关说法正确的是
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw减小 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |