高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是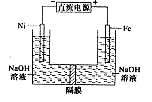
| A.铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
石灰水 |
| ② |
HCl |
CO2 |
石灰水 |
| ③ |
CO2 |
SO2 |
Ba(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2 |
| ⑤ |
CO2 |
NH3 |
CaCl2 |
A.①②③④ B.②③④⑤C.①③④ D.②③④
如图是某煤发电厂处理废气的装置示意图。下列说法中错误的是( )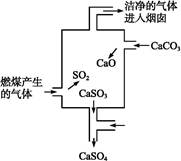
| A.使用此废气处理装置可减少酸雨的形成 |
| B.装置内发生的反应有化合、分解和置换反应 |
C.整个过程的反应可表示为:2SO2+2CaCO3+O2 2CaSO4+2CO2 2CaSO4+2CO2 |
| D.可用酸性高锰酸钾溶液检验废气处理是否达标 |
下列气体:①NH3 ②NO2 ③NO ④O2 ⑤SO2中,适于用下图装置制取和收集的气体是( )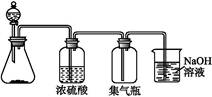
| A.①② | B.②③ | C.③④ | D.②⑤ |
通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。对下列实验事实解释正确的是( )
| 现象 |
解释 |
|
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
浓硝酸在光照条件下变黄 |
浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
| C |
在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去 |
BaCl2溶液具有酸性 |
| D |
向盐酸中加入浓硫酸时产生白雾 |
浓硫酸具有脱水性 |
下列叙述中正确的是( )
| A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| B.浓硝酸储罐泄漏时,可以立即喷撒消石灰或烧碱处理 |
| C.浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气 |
| D.分别充满NH3、HCl气体的烧瓶倒置于水中后液面均迅速上升,说明NH3和HCl气均易溶于水 |