室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是 ( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 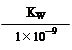 mol·L—1
mol·L—1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
下列反应中必须加入还原剂才能进行的是
| A.H+→H2 | B.CO→ CO2 | C.CO2 →CO32— | D.Fe2O3 → Fe3+ |
下列反应的离子方程式不正确的是
| A.铁与硫酸铜溶液反应: Fe + Cu2+ = Fe 2+ + Cu |
| B.镁与稀盐酸反应: Mg + 2H+ = Mg 2+ + H2↑ |
| C.氢氧化钙溶液与盐酸反应: OH-+ H+ = H2O |
D.氢氧化钡溶液与硫酸反应: Ba2+  +SO42-= BaSO4↓ +SO42-= BaSO4↓ |
关于容量瓶的使用,下列操作正确的是
| A.使用前要检验容量瓶是否漏液 |
| B.用蒸馏水荡洗后必须要将容量瓶烘干 |
| C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
D.为了使 所配溶液浓度均匀,定容后,手握瓶颈,左右振荡 所配溶液浓度均匀,定容后,手握瓶颈,左右振荡 |
下列各组中的离子,能在溶液中大量共存的是
| A.Ca2+、H+、Cl-、Ag+ | B.Cu2+、OH-、SO42-、K+ |
| C.Ba2+、OH-、NO3-、Na+ | D.K+、CO32-、Ba2+、Cl- |
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B .CH4的摩尔质量为16g
.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L