(届重庆南开中学高三二诊模拟考理综化学试卷)
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
下列对化学平衡移动的分析中,不正确的是()
① 已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
② 已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③ 有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④ 有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①③④ |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |
氢氧化镁在水中存在下列平衡:Mg(OH)2(固)≒ Mg2+ + 2OH-,加入下列物质可使Mg(OH)2固体减少的是()
| A.碳酸钠 | B.硫酸镁 |
| C.硝酸铵 | D.氢氧化钠 |
在一定温度下,可逆反应A(g)+3B(g)≒2C(g)达到平衡的标志是()
A. C的生成速率与C的分解速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
一定条件下,向一带活塞的密闭容器中充入1 mol N2和3mol H2,发生下列反应:N2(g)+3H2(g)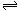 2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是()
2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是()
| A.保持温度和容器压强不变,充入1 mol NH3(g) |
| B.保持温度和容器体积不变,充入1 mol NH3(g) |
| C.保持温度和容器压强不变,充入1 mol N2(g) |
| D.保持温度和容器体积不变,充入1 mol Ar(g) |
E. 保持温度和容器体积不变,充入1 mol H2(g)