(2014届浙江省温州中学高三上学期期末理综化学试卷)
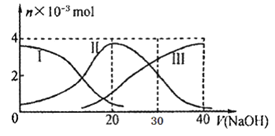
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-), 根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是: H2A === H+ + HA- ; HA-  H+ + A2-
H+ + A2-
B.当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)= c(A2-)+ 2 c(OH-)
由两种原子组成的纯净物
| A.一定是化合物 | B.可能是化合物,也可能是单质 |
| C.一定是单质 | D.一定是同素异形体 |
用NA表示阿伏加德罗常数的值,下列说法中不正确的是
| A.17g氨气中含有3NA对共用电子对 |
| B.4.48LN2与CO的混合物所含分子数为0.2NA |
| C.16g甲烷与足量的氯气在强光作用下最多可得4NA个HCl分子 |
| D.0.2 mol C2H6O分子中一定存在0.2NA个碳碳单键 |
下列说法正确的是
| A.石油的分馏和裂化均属于化学变化 |
| B.花生油、豆油、羊油和牛油均属于高级脂肪酸甘油酯 |
| C.煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D.汽油、柴油通常作为汽车的燃料,是一种清洁的燃料 |
下列试剂的贮存方法中,不正确的是
| A.浓烧碱溶液盛放在玻璃塞的玻璃瓶中 | B.少量金属钠贮存在煤油中 |
| C.浓硝酸存放在棕色试剂瓶中 | D.实验室保存液溴时可用少量水进行液封 |
下列物质中属于共价化合物的是
| A.Cl2 | B.NH4Cl | C.C2H6 | D.NaOH |