部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 (25℃) |
Ki=1.77×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
下列说法正确的是:
| A.分子式相同的不同物质一定是同分异构体 |
| B.通式相同的不同物质一定属于同系物 |
| C.相对分子质量相同的不同物质一定是同分异构体 |
| D.分子式相同,元素的质量分数也相同的物质是同种物质 |
碳碳双键不能自由旋转,所以,R—CHCH—R可能有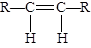 和
和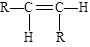 两种空间排列的形式。那么,下列化合物中具有上述两种空间排列形式的是:
两种空间排列的形式。那么,下列化合物中具有上述两种空间排列形式的是:
| A.丙烯 | B.2 – 戊烯 |
| C.苯乙烯 | D.1,3 – 丁二烯 |
某烃含碳、氢元素的质量比为6 : 1,该烃对氮气的相对密度为2,它既可使溴水褪色,又能与氢气加成,而与氢气的加成产物的二氯代物有3种同分异构体。该烃可以是:
| A.H2C |
B.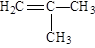 |
| C.H2C |
D. |
某温度和压强下,将4 g由3种炔烃(分子中只含有一个—C≡C—)组成的混合气体与足量的H2反应,充分加成后,生成4.4 g 3种对应的烷烃,则所得的烷烃中一定有:
| A.乙炔 | B.乙烷 | C.丙炔 | D.丙烷 |
某高分子化合物干馏后分解为A,A能使溴水褪色,1 mol A和4 mol H2加成后生成化学式为C8H16的烃,则该高分子化合物是:
A.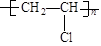 |
B. |
C.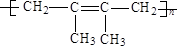 |
D.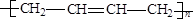 |