甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| |
实验装置 |
实验药品 |
制备原理 |
| 甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为 ① 。 |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ 。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是 。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是 。
某研究性小组同学在学习相关有机基础知识后,决定试用类似制乙酸乙酯的装置,以环己醇为主要原料制备环己烯。
已知:

(1)制备粗产品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。请回答有关问题:
①A中碎瓷片的作用是_______________,导管B除了导气外还具有的作用是____________;
②试卷C置于冰水浴中的目的是_______________.
(2)制备精品
①环己烯粗品长含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用_______________(填写编号)洗涤;
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,温度应控制在______℃左右,实验制得的环己烯制品质量低于理论产量,可能的原因是______________________.
(17分)实验室常用的几种气体发生装置如图A、B、C所示: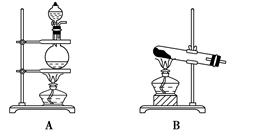
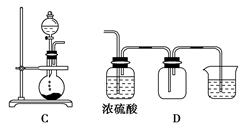
(1)实验室可以用B或C装置制取氨气,如果用B装置,通常使用的药品是________;如果用C装置,通常使用的药品是________;
检查B装置气密性的操作方法是_____________________________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。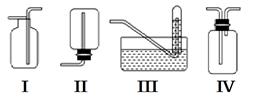
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________
①CO2 ②NO ③Cl2 ④H2
写出A装置中反应的离子方程式____________________________________
其中在D装置中连接小烧杯中应盛放________,目的是_________________________________。
若要收集干燥纯净的X气体,上述装置应如何改进________________________________
(10分)下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线: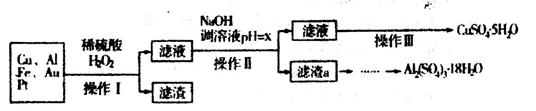
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案: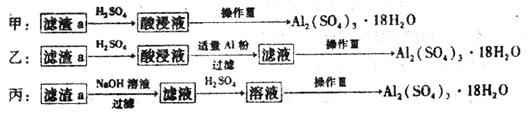
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。
(10分)欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:量筒,烧杯,玻璃棒,胶头滴管,________。
(2)现有下列配制操作:
A用量筒量取浓H2SO4B反复颠倒摇匀 C用胶头滴管加水至刻度
D洗净并干燥所用仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其正确的操作顺序为:___________。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL 、20mL、 50mL的量筒,应选用 _____mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取将使配制的浓度_____________(偏高、偏低、无影响)。
(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。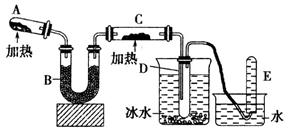
回答下列问题:
(1)A中生成氨气反应的化学方程式是_________________________________________;
(2)B中加入的干燥剂是_________(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象①C中______________、②D中有无色液体生成;
设计实验检验D中无色液的成分:取少量液体于试管中,加入少量________粉末,现象为_________。
(4)写出氨气与氧化铜反应的化学方程式___________________________;若收集到2.24L(STP)氮气,计算转移电子数为__________。