(届上海市十三校高三测试化学试卷)
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。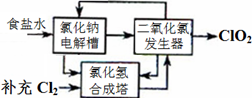
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
下图 为相互串联的甲乙两个电解池,请回答:
为相互串联的甲乙两个电解池,请回答:
((1)甲池若为用电解原理精炼铜的装置,A极是___,材料是____,电极反应为________;B极是_________,材料是__________,主要电极反应为___________,电解质溶液为_____________。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,____极附近呈红色。
(3)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为__ ______。
______。
(4)常温下若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为__________。
已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写 下列空白:
下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c (H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
有机化合物A(C5H8O2)不溶于水,并可以发生如下图所示的变化: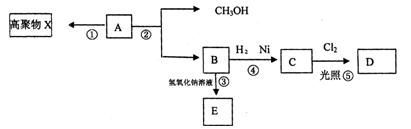
已知:C的一氯代物D只有两种
请回答:
(1)A分子中含有的官能团的名称;
(2)①②④⑤反应中属于取代反应的有(填序号);
(3)C的结构简式,X结构简 式;
式;
(4)写出②的反应方程式;
(5)写出一种C的同分异体的结构简式,并符合下列条件,①属于酯类,②能发生银镜反应。。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和 部分产物未标出)
部分产物未标出)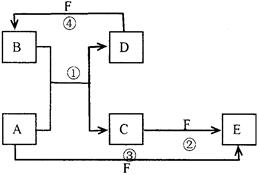
(1 ) 若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则反应④的化学方程式为:。
) 若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则反应④的化学方程式为:。
(2) 若A为金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是,
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: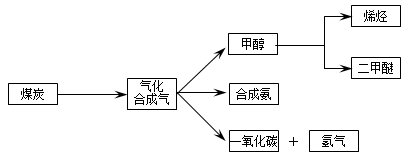
I.已知该产业链中某反应的平衡表达式为:K=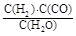 ,它所对应反应的化学方程式为。
,它所对应反应的化学方程式为。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa, 温度230~280℃)进行下列反应:
温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H1=-90.7kJ·mol-1
CH3OH(g)△H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g)△H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3=-41.2kJ·mol-1
CO2(g)+H2(g)△H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为。830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a=mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是,其原因是.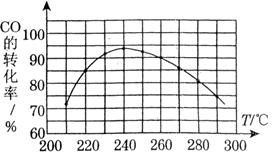
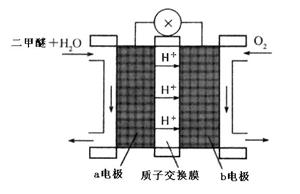
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式 。
。