硼元素B在化学中有很重要的地位。硼的化合物在农业、医院、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式 ,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。
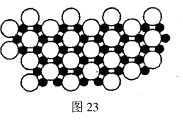
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图23是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为 。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素名称::A _______ B _______ C _______ D ______。
(2)写出化学方程式:
①C+B=,
②A+D=。
如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为,反应在10分钟内的化学反应速率用Z来表示则V(Z)=。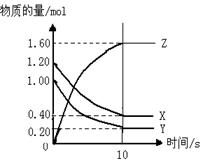
乙醇分子中的化学键如右图所示,在不同反应中断键不同:和金属钠反应键断裂;化学方程式是,在Cu催化下和O2反应键断裂,化学方程式是,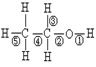
有几种元素的微粒的最外电子层结构如图所示,其中:
(1)若该微粒呈电中性且一般不和其他元素的原子反应,这种微 粒符号是。
(2)若该微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊, 这种微粒的电子式是_______。
(3)若该微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是______。
已知1,3-丁二烯(CH2=CH-CH=CH2)在一定条件下可以与同物质的量的溴发生如下1,4-加成反应: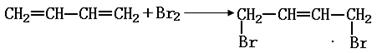
现由氯苯制备1,4-环己二醇,有以下7步反应(其中无机产物都已略去),其中有一步属于取代反应,两步属于消去反应,四步属于加成反应。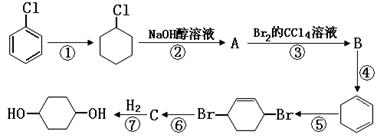
试回答:
(1)属于取代反应的是,属于消去反应的是。(填写序号)
(2)化合物的结构简式:B;C。
(3)反应④和反应⑥的反应条件:④;⑥。
(4)写出反应②的化学方程式:。