下列依据相关实验得出的结论正确的是( )
| A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| D.向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
将适量的铁粉加入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比
| A.3:2 | B.1:2 | C.2:1 | D.2:3 |
将4.34克Na、Na2O、Na2O2混合物与足量的水反应,在标准情况下得到672ml气体,将该混合气体通过电火花点燃,恰好完全反应,则它们的物质的量之比为()
| A.1:1:1 | B.1:1:2 | C.1:2:1 | D.4:3:2 |
由 四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的
四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的 在标准状况下为11.2L,则混合物中一定含有的金属是()
在标准状况下为11.2L,则混合物中一定含有的金属是()
甲、乙两烧杯中各有 的盐酸和
的盐酸和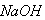 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为()
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为()
| A.5.4g | B.3.6 g | C.2.7 g | D.1.8 g |
合金相对纯金属制成的金属材料来说优点是()
①合金的硬度一般比它的各成分金属的硬度大
②一般合金的熔点比它的各成份金属的熔点更低
③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
| A.①②③⑤ | B.②③④ | C.①②④ | D.①②④⑤ |