(7分) 据报道,一辆载满20t电石的货车,在高速路上发生意外,燃起大火并伴有大量黑烟,这辆货车在雨中燃烧了很长时间。某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动。
【查阅资料】①碳化钙与水反应生成一种可燃性气体和一种白色固体。
②乙炔(C2H2)气体燃烧时伴有大量黑烟。
【猜想假设】甲同学对碳化钙与水反应的生成物作出如下猜想:
可燃性气体可能是:①氢气 ②氧气 ③乙炔
白色固体可能是: ①氧化钙 ②氢氧化钙 ③碳酸钙
(1)你认为甲同学猜想的理由是 。
(2)其他同学讨论后认为甲同学的猜想有不合理之处,请指出并说明理由
。
【实验探究】
步骤1:取适量碳化钙加水,收集生成的气体,验纯后点燃,气体燃烧,伴有大量黑烟,说明碳化钙与水反应产生的气体是 。
步骤2:取适量反应后生成的固体于试管中, ,说明碳化钙与水反应产生的固体是氢氧化钙。
【反思交流】
(1)碳化钙与水反应的化学方程式为 。
(2)下列说法正确的是 (填字母序号)。
| A.碳化钙与水反应放热 |
| B.碳化钙应贮存在阴凉干燥的库房 |
| C.碳化钙与水反应可用于测定电石中碳化钙的含量 |
| D.实验室用电石与水制乙炔的发生装置与制氧气完全相同 |
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:。
【实验与探究】
(1)分析:暴露在空气中的氢氧化钠会变质,变质原因是(用化学方程式表示)______________________
(2)实验如下:
| 实验操作步骤 |
实验现象 |
结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的_________。 |
实验过程中始终没有气泡产生。 |
则证明猜想成立。 |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 |
实验过程中产生 |
则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为 _____________________ |
(3)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想_________成立;若酚酞不变红,则猜想______成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是。
在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
(1)你认为此结论是否正确?,理由是;
(2)写出该中和反应的化学方程式;
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验操作 |
实验现象 |
结论 |
| 从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加碳酸钠溶液 |
(填“是”、“不是”)恰好完全反应 |
(4)写出(3)中可能发生反应的化学方程式
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2; 猜想二:可能只有CaCl2;
猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:,结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:。结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
a.pH试纸 b.铜 c.紫色石蕊试液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的。
假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中CO2反应,化学方程式为: |
| 可能是 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是 。
| OH- |
Cl- |
CO32- |
NO3- |
|
| Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 |
|
白色粉末中含有Ca(OH)2 |
| 往上述试管内残留的固体中加入足量稀盐酸 |
固体溶解,产生气泡 |
白色粉末中 |
| 由上述实验可知白色粉末的成分是: |
||
(3)交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是_______(填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
甲、乙、丙、丁四位同学在探究实验时发现了个意外的现象:氢氧化钠溶液中滴入酚酞试液,溶液变成红色,可是过了一会儿红色就消失了。这是什么原因呢?他们依据所学的化学知识,分别对意外现象的成因做了如下猜想:
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应使红色消失;
丁:可能是氢氧化钠溶液的浓度过高引起的。
;
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
(3)四位同学讨论后认为要验证丙同学的猜想,还需作如下实验,你知道其实验目的吗?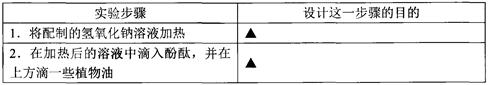
通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。
(4)若丁同学的猜想正确,大家能设计实验证明吗?