对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙
2NH3(g),△H=-92.4 kJ.mol-1下列叙
述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
下列说法不正确的是
| A.浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
| B.胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 |
| C.利用丁达尔效应可以区分溶液和胶体 |
| D.将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体 |
下列物质的分类不正确的是
| A.水、过氧化氢和干冰都属于氧化物 |
| B.H2SO4、HNO3、H2CO3都属于酸 |
| C.烧碱、纯碱、熟石灰都属于碱 |
| D.NaHSO4、CuSO4和KMnO4都属于盐 |
下列物质中,不属于电解质的是
| A.H2SO4 | B.NaOH | C.NaCl | D.C2H5OH |
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是
①ω=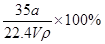 ②C=
②C=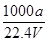
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
| A.②④ | B.②③ | C.①③ | D.①④ |
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- ≒ H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液
②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.四种溶液中c(HA-)浓度大小:③>①>②>④
B.溶液①中一定不存在OH-
C.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)=0.04mol/L
D.溶液②中存在水解平衡:HA—+H2O≒ H2A+OH