下列各组离子一定能大量共存的是
| A.加入铝粉有氢气产生的溶液中Na+、K+、SO42-、Cl-、HCO3- |
| B.含有大量硝酸根离子的溶液中H+、Fe2+、SO42-、Cl- |
| C.常温下,c(H+)/c(OH-) = 1×10-10的溶液中NH4+、K+、Ca2+、Cl- |
| D.常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+ |
.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是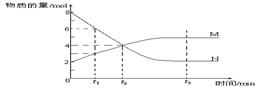
A.反应的化学方程式为:2M N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率等于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述不正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
| A.X与Y不可能位于同一主族 |
| B.X与Y一定位于同一周期 |
| C.X与Y可能形成共价化合物XY |
| D.X与Y可能形成离子化合物XY |
.某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四种实验:①将镁粉投入到冷水中,未观察到明显现象;②将镁粉投入到溴水中,观察到只是开始时产生极少量的气泡,但溴水会慢慢退色;③将镁粉投入到液溴中,未观察到明显现象;④向含有足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。下列关于镁粉与溴水的反应机理的叙述中正确的是
| A.镁粉只直接与溴水中的溴反应 | B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到的 | D.镁粉在水的催化下与溴发生反应 |
将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是
| A.甲装置子中电能转化为化学能 | B.乙装置中电能转化为化学能 |
| C.甲装置中铜片表面有气泡产生 | D.乙装置中铜片表面有气泡生成 |